SOAPS - это натриевые или калиевые соли высших карбоновых (жирных) кислот, в основном стеариновой и пальмитиновой.
C15H31COOH + NaOH → C15H31COONa + H2O
Пальмитат натрия (мыло)
Стеариновая кислота реагирует с гидроксидом натрия, о чем свидетельствует изменение цвета индикатора. В этой реакции стеариновая кислота ведет себя как другие кислоты, образуя соли с основаниями. Нагретое вещество интенсивно пенится, после охлаждения белая, гладкая на ощупь масса, которая растворяется в воде, а после встряхивания - пенообразование. Реакция привела к соли стеариновой кислоты - мылу.
Как соли слабых кислот и сильных оснований, они подвергаются анионному гидролизу в воде, проявляя основную реакцию.
C17H35COONa + H2O → NaOH + C17H35COOH
C15H31COONa + H2O → C15H31COOH + NaOH
C15H31COO- + Na + + H2O → C15H31COOH + Na + + OH- (основание натрия)
Мыльная сода жесткая и белая, а калиевые мыла - серые и комковатые. Туалетное мыло, используемое для повседневной гигиены, - это очищенные (с лучшими свойствами) натриевые мыла с добавлением увлажняющих веществ, масла, кокосового масла, ароматических масел и красителей.
Несколько характерных реакций:
C15H31COONa + MgCl2 → (C15H31COO) 2Mg2 + 2NaCl
C15H31COO- + Mg2 + → (C15H31COO) 2 мг
C15H31COO- + Ca2 + → (C15H31COO) 2Ca¯
Мыла в качестве поверхностно-активных веществ:
Исследуя поверхностное натяжение воды и мыльного раствора, замечено, что бритва, осторожно размещенная на поверхности водопроводной воды, не тонет. Это связано с большим поверхностным натяжением воды, которое в упрощенном виде может быть представлено как своего рода мембрана на поверхности воды, а также других жидкостей. Поверхностное натяжение заставляет воду образовывать капли, и плоские, легкие объекты могут удерживаться на ее поверхности. Такая вода слабо увлажняет стекло, кожу или материалы. Поверхности и материалы, легко смачиваемые водой, называются гидрофильными (то есть водолюбивыми), например мел , дерево, хлопчатобумажная ткань. С другой стороны, тех, кого мы называем влажной водой, называют гидрофобными (те, кто не любит воду), например, пластмассы, жир.
В мыле и воде бритва тонет, это указывает на более низкое поверхностное натяжение этого раствора и способность мыла снижать поверхностное натяжение воды. Мыло и вода легче проникают в ткань или кожу, и поэтому лучше удалять с них частицы грязи, представляющие собой смесь различных соединений, например сажи, кремнезема, минеральных солей, красителей, пота, жира или белок , Плотно прилипает к поверхности ткани или кожи и не может быть легко удален механически или плохо увлажненной водой. Чтобы улучшить смачиваемость и эффективно удалить грязные пятна, уменьшите поверхностное натяжение воды, добавив мыло или другое вещество с аналогичными свойствами (например, моющее средство). Такие вещества называются поверхностно-активными веществами. Они улучшают смачиваемость жира молекулами воды. Механическое трение во время стирки и перемешивание во время стирки приводят к образованию водной эмульсии. Образующаяся при этом пена удерживает частицы грязи на поверхности и, таким образом, облегчает их удаление и предотвращает повторное прилипание к очищаемой поверхности. Поверхностно-активные вещества имеют свои свойства благодаря характерной двойной структуре: гидрофобная часть (углеводород жирной кислоты) прилипает к гидрофобным частицам, присутствующим в взвеси грязи и воды, а гидрофильная часть (ионная функциональная группа - COO-) вместе с сопровождающими ее катионами направлена на полярные молекулы вода. Они отделяют частицы грязи с очищаемой поверхности, заваривают их пеной и поднимают их на поверхность воды, откуда они смываются.
ESTRY - важная группа органических соединений. Они сделаны из комбинаций карбоновых кислот и спиртов. Общая формула сложных эфиров алифатических карбоновых кислот:
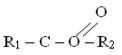
Где: - R1 - алкильная группа, полученная из карбоновых кислот или водорода
- R2 - алкильная группа, полученная из спиртов
- COO - эфирная группа
Сложные эфиры карбоновых кислот можно рассматривать как производные кислот, в которых группа
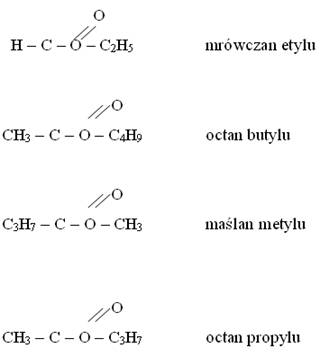
-ОН карбоксильной группы замещен группой OR2, а R2 представляет собой алкильный радикал, полученный из спиртов. Названия сложных эфиров состоят из двух слов, таких как названия солей. Первая часть названия сложного эфира происходит от названия карбоновой кислоты, из которой был образован сложный эфир. Например, сложный эфир муравьиной кислоты представляет собой формиат, уксусная кислота - ацетат, пропионовая кислота - пропионат, масляная кислота - бутират. Вторая часть названия сложного эфира - это производный от спирта алкил, например, метиловый спирт дает название ... метил, этиловый спирт - ... этил и т. Д. Иногда также используются названия по схеме:
"Эстер ... новая кислота ..."
Например, пропиловый эфир уксусной кислоты, бутиловый эфир муравьиной кислоты. Ниже приведены примеры названий и дизайнов сложных эфиров:
Реакция этилового спирта с уксусной кислотой дает сложный эфир: этилацетат и воду. Реакция представлена уравнением:
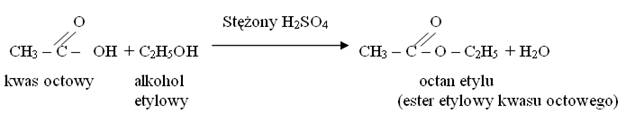
В присутствии концентрированной серной кислоты (VI) карбоновые кислоты реагируют со спиртами, давая сложные эфиры - соединения с интенсивным приятным запахом - и воду. Реакция образования сложного эфира называется реакцией этерификации. Вы можете сохранить его как правило:
кислота + спирт → эфир + вода
Вода в этой реакции образуется из гидроксильной группы кислоты и из атома водорода группы -ОН. Реакции этерификации катализируют ионы H +, полученные в результате диссоциации сильных неорганических кислот, например H2SO4. Под воздействием своего основного продукта, сложного эфира в результате реакции воды, он начинает распадаться на исходные субстраты - спирт и кислоту. Таким образом, этерификация является обратимой реакцией, в которой состояние динамического равновесия определяется через определенное время. Чтобы предотвратить обратную реакцию и увеличить выход сложных эфиров, сдвиньте баланс реакции вправо. Это может быть достигнуто либо удалением полученного продукта из реакционной среды, либо добавлением субстрата (например, спирта). Чаще всего вода связана или эфир удален (например, дистилляцией)
H2SO4 обладает гигроскопическими свойствами, поэтому он связывает образующуюся воду и в то же время обеспечивает ионы H +, которые катализируют образование сложного эфира.
Обратной реакцией к этерификации является реакция гидролиза сложного эфира, состоящая в разложении сложного эфира до воздействия воды на кислоту и спирт:
эфир + вода → кислота + спирт
например.
HCOOC3H7 + H2O → HCOOH + C3H7OH
кислота пропилформиат спирт
формил пропил

Этилацетат - свойства:
Эфир, нагретый чистой водой, не изменяется в значительной степени, реакция с H2SO4 обнаруживает исчезновение запаха эфира и появление уксусной кислоты, в то время как реакция с добавлением NaOH обнаруживает запах этанола. Эти наблюдения можно объяснить гидролизом этилацетата:
В кислой среде гидролиз этилацетата протекает в соответствии с уравнением реакции:
CH3COOC2H5 + H2O → CH3-COOH + C2H5OH
этилацетат уксусная кислота этиловый спирт
Гидролиз этого эфира в присутствии гидроксида натрия протекает по уравнению реакции:
CH3COOC2H5 + NaOH → CH3-COONa + C2H5OH
этилацетат этилацетат этиловый спирт
В кислой и нейтральной среде в реакции гидролиза сложного эфира устанавливается состояние равновесия, а в основной среде реакция практически необратима и приводит к образованию соли.
Низшие эфиры являются летучими жидкостями, поскольку их углеродная цепь растет, их плотность увеличивается, они превращаются в маслянистые жидкости, а затем в твердые вещества. Они почти не растворяются в воде, а часто являются хорошими растворителями для других органических соединений. Поэтому они используются для производства лакокрасочных материалов и в качестве растворителей.
Эфиры имеют приятные запахи цветов и фруктов:
- Этилформиат HCOOC2H5 - аромат рома
- N-пентилацетат CH3COOC5H11 - груши
- C3H7COOC6H5 этилбутират - запах ананасов
- Фенилацетат CH3COOC6H5 - аромат жасмина
- N-бутилацетат CH3COOC4H9 - аромат бананов
Эфиры с гвоздикой, клевером и сосной также могут быть легко получены. Все эти эфиры встречаются в природе. Цветы, плоды или корни некоторых растений имеют приятный запах сложных эфиров. Благодаря своим свойствам сложные эфиры и их смеси нашли применение при производстве растительных ароматов. Они производят духи, цветочные воды, мыло, ароматические эссенции. Они также используются в качестве вкусовых добавок для кондитерских изделий. Сложные эфиры карбоновых кислот с длинной цепью встречаются в природе в форме полужидких веществ, которые выглядят как жир или воск. Они выполняют важную функцию в природе - покрытые ими листья не теряют влагу так быстро, благодаря чему растения защищены от высыхания. Важной группой сложных эфиров также являются соединения, известные как жиры. Сложные эфиры спиртов с неорганическими (минеральными) кислотами известны. Наиболее популярным в этой группе является (V) глицерол триазотат, поскольку он не нитросоединение, а сложный эфир. Это соединение образуется в результате реакции этерификации глицерина концентрированной азотной кислотой (V) в присутствии концентрированной H2SO4. Триазотат (V) глицерина представляет собой:
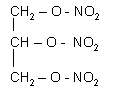
Это маслянистая, слегка желтая жидкость, чрезвычайно чувствительная к ударам, при которой она сильно взрывается. Эта особенность была использована для производства взрывчатых веществ, особенно динамита. Тринитрат (V) глицерин также используется при ишемической болезни сердца как вазодилататор.
Другие эфиры неорганических кислот, например этил (III) нитрат C2H5ONO или нитрат (III)
n - пентил C5H11ONO, используется в медицине в качестве сосудорасширяющих и гипотензивных средств. Сложные эфиры серной кислоты (VI) и спирты с длинными неразветвленными углеродными цепями нашли применение в производстве моющих средств. Эфиры фосфорной кислоты (V) встречаются в живых организмах, где они участвуют в биохимических процессах.
жИРЫ
Жиры - это вещества, которые широко распространены в природе. Они встречаются в тканях животных и в семенах растений. Многочисленные жиры хорошо известны из повседневной жизни, потому что они являются одним из основных ингредиентов пищи, которую вы едите. Наиболее важными жирами животного происхождения являются сало, масло и жир. Растительные жиры - это, прежде всего, разные масла - рапсовое, подсолнечное, соевое и другие.
Химически жиры - это сложные эфиры глицерина и карбоновых кислот, чаще всего с длинными цепями (отсюда и общее название этих кислот - жирные кислоты). Поскольку молекула глицерина имеет три гидроксильные группы, в ее сложноэфирной молекуле есть три кислотных остатка.
Кислотные остатки в молекуле жира могут быть одинаковыми (R1 = R2 = R3), такая структура имеет только синтетические жиры или разные жиры (в натуральных жирах).
Жир состоит из нескольких десятков разных кислот. Они включают насыщенные - сливочное масло, пальмитиновую, стеариновую и другие кислоты и ненасыщенные с одной или несколькими двойными связями (например, олеиновую, линолевую, линоленовую).
Жиры являются твердыми, полутвердыми (с консистенцией мазка) или маслянистыми жидкостями. Они практически нерастворимы в воде и очень мало растворимы в этиловом спирте, но хорошо растворяются в углеводородах, фторированных углеводородах и других неполярных растворителях. Хорошая растворимость жиров в углеводородах используется для их выделения из масличных культур (например, подсолнечника, рапса, льна, сои и т. Д.). Семена измельчают и нагревают с растворителем, после чего полученный жировой раствор перегоняют. Восстановленный растворитель рециркулируется для повторного использования, а жир, остающийся после перегонки, подвергается очистке (так называемая очистка).
Жиры, как и другие эфиры, подвергаются гидролизу. Основные гидро Лиза Жиры, называемые реакцией омыления, известны человеку очень давно. Его продукты: соли глицерина и жирных кислот, то есть мыло.
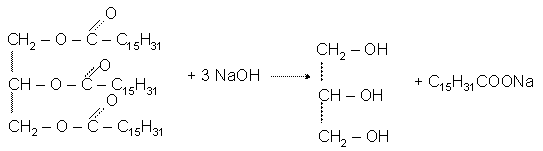
До недавнего времени омыление жиров было единственным методом получения глицерина и мыла. В настоящее время они также производятся синтетически из сырья, полученного из сырой нефти, что позволяет использовать большее количество жиров для пищевых целей.
Гидролиз жиров также происходит в пищеварительном тракте животных и человека. Жиры, введенные с пищей, подвергаются гидролизу под воздействием биохимических катализаторов - ферментов, называемых липазами.
При обсуждении физических свойств жиров, возможно, известны твердые и жидкие жиры. Оказывается, что концентрация жира зависит от наличия двойных связей в цепях кислотных остатков. В твердом жире эти цепи в основном насыщены, тогда как в жидких жирах преобладают цепи с одной или несколькими двойными связями.
Жидкие жиры могут превращаться в твердые вещества в реакции каталитического гидрирования двойных связей. Этот процесс называется лечением жира. Частично гидрогенизированные масла, в которых остаются некоторые двойные связи, используются для производства маргарина - так что некоторые несъедобные растительные масла можно использовать в пищевых целях. Маргарин - в дополнение к частично гидрогенизированным маслам - также содержит добавки, такие как витамин , красители, минеральные соли и молоко , благодаря которому он имеет вид и питательные свойства, похожие на масло.
Растительные масла, содержащие кислотные остатки с высокой степенью ненасыщенности, используются для производства масляных красок. Эти краски включают в себя: лак, представляющий собой растительное масло (обычно лен) с примесями, ускоряющими отверждение лакокрасочного покрытия, пигмент, придающий краске цвет, и разбавитель, облегчающий его нанесение на объект с покрытием.
АМИНЫ - это органические производные аммиака, NH3, аналогично спирты и эфиры являются органическими производными воды. Амины, как и аммиак, содержат атом азота со свободной парой электронов, что приводит к тому, что амины обладают как нуклеофильными, так и основными свойствами. Амины широко распространены как в растительных, так и в животных организмах. Например, триметиламин обнаружен в тканях животных и частично отвечает за характерный запах многих рыб, хинин является важным противомалярийным препаратом, выделенным из коры южноамериканского хинного дерева, а кодеин является анальгетиком (болеутоляющим), присутствие которого обнаружено в опийном маке.
Названия аминов.
Различают первичные (1 ° RNH2), вторичные (2 ° R2NH) и третичные (3 ° R3N) амины в зависимости от количества органических заместителей, связанных с атомом азота. Например, метиламин CH3NH2 представляет собой первичный амин, диметиламин (CH3) 2NH представляет собой вторичный амин, а триметиламин (CH3) 3N представляет собой третичный амин. Стоит отметить, что использование порядка 1 °, 2 °, 3 ° в случае аминов немного отличается от ранее использованных. Когда мы говорим о третичном алкиловом спирте или галогениде, мы определяем степень замещения у алкильного атома углерода, тогда как когда мы говорим о третичном амине, мы определяем степень замещения у атома азота.
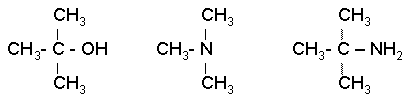
трет- бутиловый спирт, триметиламин трет- бутиламин
(3 ° спирт) (3 ° амин) (1 ° амин)
Существуют также соединения, содержащие атом азота с четырьмя присоединенными группами, но затем на азоте появляется положительный заряд. Такие соединения называются четвертичными аммониевыми солями.
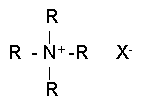
Амины классифицируются как алифатические (с алкильным заместителем) и как ароматические (с арильным заместителем). Большинство химических свойств этих двух классов соединений схожи, но существующие различия настолько значительны, что они обсуждаются отдельно.
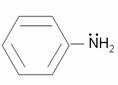
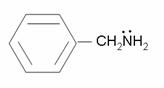
метиламин анилин бензиламин
(алифатический амин) (ароматический амин) (алифатический амин)
Первичные амины (1 ° RNH2) можно назвать несколькими способами, в зависимости от их структуры. Например, суффикс -амин присоединяется к названию алкильного заместителя:
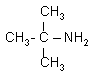
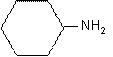
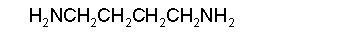
трет-бутиламин циклогексиламин 1,4-бутандиамин
В качестве альтернативы суффикс -амин может быть присоединен к имени родительского соединения, вставляя букву «о» между двумя элементами:
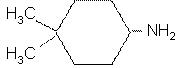
4, 4 -dimetylocykloheksanoamina
Амины с более чем одной функциональной группой имеют название, обозначающее группу NH2 как амино-заместитель у исходного соединения:
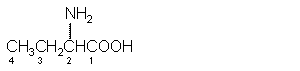
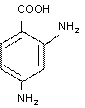
2-аминобутановая кислота 2,4-диаминобензойная кислота

4-амино-2-бутанон
Симметричные вторичные и третичные амины названы путем добавления префикса ди- или три- к алкильной группе:
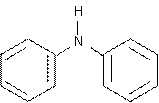
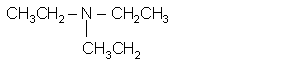
дифениламин триэтиламин
Замещенные асимметричные вторичные и третичные амины обозначаются как N- замещенные первичные амины. Название самой большой алкильной группы выбрано в качестве родительского имени, а оставшиеся алкильные группы считаются N- родителями родительской системы ( N, потому что они присоединены к атому азота):
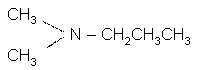
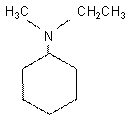
N, N- диметилпропиламин N- этил- N- метилциклогексиламин
[пропиламин - это родительское имя; [циклогексиламин является родительским именем;
2 метильные группы SA с метильными и этильными заместителями являются заместителями у атома азота
у атома азота (N)] (N)]
Существует довольно мало общих названий для простых аминов, но правила именования допускают названия: анилин для аминобензола, толуидин для аминотолуола.
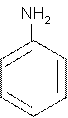
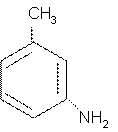
м-толуидин анилин
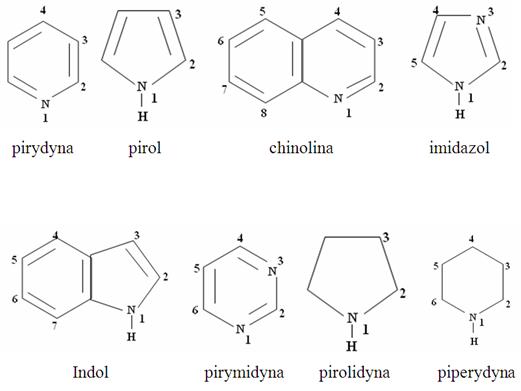
Гетероциклические амины, соединения которых атом азота образует часть кольца, также имеют общие названия, и каждая отдельная гетероциклическая кольцевая система имеет свое собственное родительское название. Гетероциклический атом азота всегда обозначается как позиция 1.
Физические свойства аминов:
Амины с менее чем пятью атомами углерода похожи на растворимую в воде воду. Как и в случае спиртов, первичные и вторичные амины образуют водородные связи и тесно связаны между собой. В результате амины проявляют более высокие точки кипения, чем алканы с одинаковой молекулярной массой. Например, диметиламин кипит при 56,3 ° С, а пентан кипит при 36,1 ° С.

диметиламин пентан
Другой характеристикой аминов является их запах. Низкомолекулярные амины, такие как триметиламин, имеют характерный запах, похожий на запах несвежей рыбы.
Аминная подлость.
Химические свойства аминов определяются наличием пары свободных электронов у атома азота. Из-за этого амины являются как основными, так и нуклеофильными. Они реагируют с кислотами с образованием кислотно-основных солей, а также реагируют с электрофилами во многих полярных реакциях. Амины являются более основными, чем спирты, эфиры и вода. Когда амин растворяется в воде, устанавливается баланс, при котором вода действует как протонная кислота и передает протон амину. Может быть измерена сила аминного основания, а также активность карбоновой кислоты может быть определена путем определения ее константы кислотности. В случае амина основность Kb определяется аналогично:
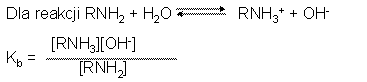
Щелочность амина часто используется в процедуре очистки. Например, если смесь основного амина и инертного соединения, такого как кетон, спирт или эфир, растворяют в органическом растворителе и экстрагируют водным раствором кислоты, основной амин растворяется в водном слое в форме его предполагаемой соли, в то время как нейтральное соединение он останется в слое органического растворителя. Разделение слоев, подщелачивание и экстракция водного слоя органическим растворителем затем даст раствор очищенного амина:
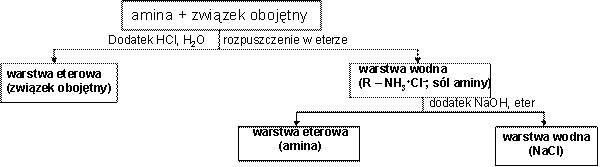
Первичные и вторичные амины, помимо того, что ведут себя как основания, также могут реагировать как слабые кислоты, поскольку протон N- H может быть отделен достаточно сильным основанием.
Промышленные источники и применение алкиламинов.
Алкиламины используются во многих случаях в качестве субстратов в химической и фармацевтической промышленности для приготовления инсектицидов и лекарств. Например, пропранолол, сердечный агент, используемый при лечении аритмии сердца, получают реакцией эпоксида в изопропиламине.
Простые метиламины получают взаимодействием аммиака с метанолом в присутствии оксида алюминия в качестве катализатора. Реакция дает смесь моно-, ди- и триметиловых продуктов, однако она полезна в промышленном масштабе, поскольку разделение трех продуктов дистилляцией не представляет трудностей.
Похожие
Больше, чем здоровое питание Как сочетать пищу?... амины жирорастворимый (A, D, E, K). С другой стороны, это самый конденсированный источник энергии, и если после жирной еды вы не ожидаете физической активности (сжигание потребляемых калорий), тогда ваш настороженный организм отложит ее на потом в виде жира . Возвращаясь к достоинствам, мы можем сочетать крахмал с жиром, то есть хлеб или кашу с маслом, все в порядке. Зеленые овощи Как быстро забеременеть в тридцать? 10 советов от экспертов
Возраст является одним из наиболее важных факторов, влияющих на возможность забеременеть. Однако не стоит забывать и о других очень важных элементах. Как быстро забеременеть в тридцать? Смотрите советы врача и диетолога. Как быстро забеременеть в тридцать?

