Трудно найти четкое определение и стандарты для дистиллированной, деминерализованной и деионизированной воды. Чтобы познакомиться с этой темой производства сверхчистой воды, проще всего начать со старого и очень известного метода: дистилляции.
Дистиллированная вода - это вода, которую кипятят в натюрморте (дистилляторе), а затем снова смешивают в конденсаторе до жидкой формы. Дистилляция для очистки воды. Растворенные примеси, такие как соли, остаются в сосуде, где происходит кипение, и вода «выходит» в виде водяного пара. Перегонка может не дать положительных результатов, если загрязняющие вещества являются летучими (например, спирты), потому что они также сохраняют и затем снова уплотняются (с образованием жидкости). Некоторые дистилляторы могут выборочно приносить только воду для уплотнения, но большинство из них допускают прохождение некоторых летучих загрязнителей и небольшого количества нелетучих элементов с водой в конденсатор (они переходят в водяной пар с пузырьками, образующимися на поверхности кипящей воды). Максимальное качество воды, достигаемое в этих системах, обычно составляет 1,0 МВт / см; и поскольку нет защиты от попадания растворенного CO2 в дистиллят, pH обычно составляет 4,5-5,0. Кроме того, вы должны быть осторожны, чтобы не загрязнять воду после ее дистилляции.
Дежонизация: это происходит при использовании смолы ионообмен (ионообменники) которые удаляют ионизированные соли из воды. Теоретически, вы можете достичь 100% удаления соли. В этом процессе обычно не удаляются органические загрязнители, вирусы или бактерии, за исключением случайного «улавливания» смолы или использования специально созданных анионных смол для удаления грамотрицательных бактерий [4].
Деминерализация: любой процесс удаления минералов из воды, хотя обычно этот термин ограничен концепцией процесса ионный обмен [1]
Ультра чистая вода: Очищенная вода в высокой степени, с высокой стойкостью и отсутствием органических соединений; обычно используется в производстве полупроводников и в фармацевтической промышленности [4]
Дежонизация основана на удалении электрически заряженных (ионизированных) растворенных веществ путем связывания их с положительно или отрицательно заряженными смола во время потока воды через колонку, заполненную смолой. Этот процесс называется ионный обмен и может использоваться многими способами для получения воды различного качества.
- система смола : Сильный кислотный катион + сильный сильный анион
Эти системы состоят из двух резервуаров: один из них содержит катионообменную смолу (катионит) в форме водорода (H +), а другой - анионит (анионит) в гидроксильной (OH-) форме (см. Рисунок ниже). Вода течет через катионную колонку, где все катионы обмениваются на ионы водорода. Вода с удаленными катионами течет дальше через колонку анионов. На этот раз все отрицательно заряженные ионы обмениваются на гидроксильные ионы, которые затем соединяются с ионами водорода с образованием воды ( H2O ) [2]
Эти системы удаляют все ионы, в том числе кремнезем. Обычно рекомендуется уменьшить ионный поток, проходящий через анионит (анионный ионит), установив блок удаления CO2 между резервуарами. Это снижает концентрацию углекислого газа до нескольких мг / л и уменьшает объем сильного анионного основания и потребности в реагентах во время регенерации. В общем, система с сильной кислотой и сильным катионитом является самым простым применением, и деионизированная вода в этой системе имеет множество применений [3]
![В общем, система с сильной кислотой и сильным катионитом является самым простым применением, и деионизированная вода в этой системе имеет множество применений [3]](/wp-content/uploads/2019/11/ru-deionizirovannaa-demineralizovannaa-voda-1.gif)
- Система смол: сильный катион кислоты + слабое основание анионита + анион сильного основания
Эта комбинация представляет собой вариант, описанный выше. Обеспечивает такое же качество деионизированной воды, что дает дополнительные экономические преимущества при очистке воды, содержащей высокие концентрации сильных анионов (хлоридов и сульфатов). Система оснащена дополнительным анионитом со слабым основанием перед окончательной смолой из сильного основания аниона. Дополнительный (дополнительный) блок удаления диоксида углерода может быть установлен либо сразу после катионита, либо между двумя анионитами (см. Рисунок ниже). Регенерация анионообменников происходит с использованием раствора гидроксида натрия (NaOH), проходящего сначала через теплообменник с сильным основанием, за которым следует слабое основание. Этот метод требует меньше гидроксида натрия, чем метод, описанный выше, потому что оставшегося раствора для регенерации после прохождения через теплообменник с сильным основанием обычно достаточно для полной регенерации смолы со слабым основанием. Кроме того, когда вода содержит высокую концентрацию органического вещества, смола слабого основания защищает теплообменник сильного основания [3].
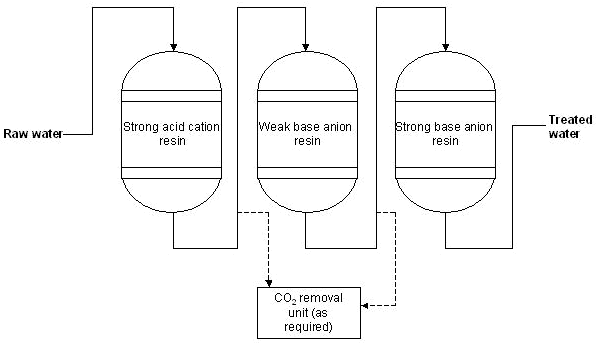
- Dejonizacja со смешанным слоем (деионизация смешанного слоя)
В деионизаторах со смешанным слоем катионообменная и анионообменная смолы объединены в одном корпусе под давлением. Обе смолы смешиваются под действием сжатого воздуха; весь осадок можно рассматривать как бесконечное число катионообменных и анионообменников, расположенных последовательно ( смешанная смола ) [2,3].
Для регенерации обе смолы гидравлически (в воде) разделяются во время фазы релаксации. Поскольку анионообменник легче катионной смолы, он плавает на поверхности, а катионная смола падает на дно. После отделения смол проводят регенерацию с помощью гидроксида натрия и сильной кислоты. Избыток любого восстановленного вещества удаляют, промывая каждую смолу отдельно.
Преимущества этой системы:
- вода, полученная в процессе, является высокоочищенной, и ее качество остается постоянным на протяжении всего цикла,
- рН практически нейтрален,
- требования к воде, используемой при стирке, невысоки.
Недостатком этой системы является меньшая емкость / обменная емкость и более сложные процедуры обработки из-за стадии разделения и повторного соединения смол [3].
В дополнение к ионообменным системам, деионизированная вода может быть получена с использованием процесса обратный осмос , Обратный осмос (RO) - самый известный метод фильтрации воды. Этот процесс позволяет удалять небольшие молекулы, такие как ионы, из раствора. Обратный осмос используется для очистки воды и удаления солей и других примесей для улучшения цвета, вкуса и других свойств жидкости. Этот процесс позволяет удалять бактерии, соли, сахара, белки, другие молекулы, краски и другие компоненты с молекулярной массой более 150-250 дальтон. Это позволяет достичь большинства стандартов качества воды после одного прохода и самых высоких стандартов в системах двойного водоснабжения. Этот процесс удаляет 99,9 +% вирусов, бактерий и лихорадочных элементов. Давление в диапазоне от 50 до 1000 фунтов на квадратный дюйм (от 3,4 до 69 бар) является движущей силой в процессе обратного осмоса. Этот процесс намного более энергоэффективен по сравнению с процессами фазовых переходов (дистилляция) и более эффективен, чем сильные химические соединения, необходимые в процессе ионообменной регенерации. Разделение ионов во время RO происходит благодаря заряженным частицам. Это означает, что растворенные несущие заряд ионы, такие как соли, в большей степени отбрасываются мембраной, чем незаряженные ионы, такие как органические соединения. Чем больше нагрузка и чем больше молекула, тем больше вероятность, что она будет удалена [4].
Очистка воды / измерение очистки
Чистота воды может быть измерена различными способами. Один метод определяет вес всех растворенных элементов («растворенного вещества»): его легче всего делать с растворенным твердым веществом, а не с растворенным газом или другой жидкостью. Помимо измерения веса примесей в воде, вы можете определить их уровень по степени, до которой они повышают температуру кипения или понижают температуру замерзания воды. На показатель преломления (преломление) (меру того, как прозрачные материалы вызывают изгиб светового луча) также влияют вещества, растворенные в воде. Чистота воды также может быть определена на основе электрической проводимости или сопротивления; Очень чистая вода плохо проводит электричество, поэтому ее сопротивление велико.
![[2]](/wp-content/uploads/2019/11/ru-deionizirovannaa-demineralizovannaa-voda-3.jpg) [2]
[2]
Чистая вода слегка кислая, а дистиллированная вода имеет рН около 5,8. Это связано с тем, что углекислый газ из воздуха растворяется в дистиллированной воде. Он растворяется до тех пор, пока его концентрация не достигнет равновесия с содержанием в воздухе. Это означает, что растворенное количество растворяет количество, поступающее в раствор. Общее содержание в воде зависит от концентрации в атмосферном воздухе. Растворенный углекислый газ реагирует с водой с образованием углекислоты.
2 H2O + CO2 -> H2O + H2CO3 (углекислота) -> (H30 +) (заряженная подкисленная вода) + (HCO3-) (заряженный ион гидрокарбоната)
Только недавно дистиллированная вода имеет значение pH около 7, но под воздействием растворенного углекислого газа она достигает слегка кислого значения pH в течение нескольких часов. Кроме того, стоит отметить, что pH ультрачистой воды трудно измерить. Это связано с тем, что эта вода быстро улавливает загрязняющие вещества, например, CO2, такие как изменения pH; но он также имеет низкую проводимость, что может повлиять на точность измерения pH. Например, абсорбция всего лишь нескольких частей на миллион диоксида углерода может вызвать снижение pH ультра чистая вода до 4,5, хотя эта вода по-прежнему высокого качества.
Наиболее точное измерение pH сверхчистой воды достигается путем измерения ее сопротивления. Для данного сопротивления pH должен быть в определенном диапазоне. Например, если водостойкость составляет 10,0 МВт / см, pH должен быть в пределах от 6,6 до 7,6. Соотношение между сопротивлением и значением pH воды высокой чистоты представлено на графике ниже [2].
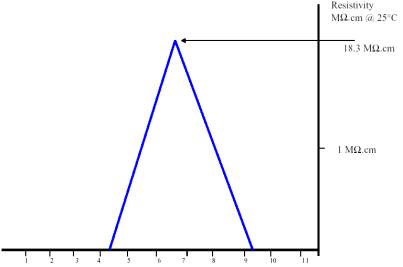
Электрическое сопротивление в зависимости от рН деионизированной воды [2]
Тип жидкостиpH
Молоко 6,5 Дистиллированная вода 5,8 Пиво 4,0-5,0 Кофе 2,5-3,5 Апельсиновый сок 3,5 Газированные напитки 2,0-4,0 Coca Cola 2,5 Вино 2,3-3,8 (желудочная кислота) 1,0-2,0 (аккумуляторная кислота) 1,0
По сравнению с другими видами жидкости, деионизированная вода явно слабокислотная pH (рН) ,
Согласно Руководству Мерк, человеческий организм использует буферные вещества для балансировки рН. Если человек потребляет что-то кислое, в крови образуется больше бикарбоната и меньше углекислого газа, чтобы нейтрализовать кислотную реакцию. И наоборот, при потреблении щелочного вещества в крови образуется больше углекислого газа и меньше бикарбоната. Таким образом, потребление дистиллированной воды не вызовет кислотной реакции в организме человека.
источник:
[1] Ф.Н. Кеммер; Справочник по воде Nalco; 2. издание; 1988
[2] www.purite.com
[3] Дегремонт; Справочник по очистке воды; шестое издание; 1991
[4] Справочник по чистой воде Osmonics; 2. издание; 1997
Вы можете увидеть больше терминологии в нашей Словарь о воде или в обзоре FAQ о воде
Если вам известны какие-либо другие интересные или новые книги, публикации, отчеты или статьи по деионизированной или деминерализованной воде, пожалуйста, сообщите нам, что мы можем разместить на нашем сайте более интересные факты по этой теме.
Похожие
Качество воды в установке центрального отопления и полы с подогревомВ статье я затрону тему: качество воды в установке. Не всегда подрядчики обращают внимание на точное качество воды, обеспечивающей бытовую циркуляцию. А жесткая вода может вызвать быстрое отложение накипи в установке ... Установки, соприкасающиеся с водой, подвержены неблагоприятным изменениям, которые могут представлять собой отложение отложений (например, карбоната кальция - CaCO3) на стенках каналов или коррозию материалов, из которых они изготовлены. В первом случае это может привести рН воды и ее баланс
Баланс кислотности воды в бассейне важен по двум причинам. Во-первых, средства по уходу за водой работают лучше, а во-вторых, вода более приятна для кожи человека. Кислотность воды измеряется с использованием шкалы, единицей которой является pH. PH 7,0 означает нейтральный, pH ниже 7,0 является кислым, а pH выше 7,0 является щелочным. Слеза в человеческом глазу имеет рН 7,4. Это также оптимальный рН для воды в бассейне. К сожалению, эффект хлора наиболее эффективен при Вода на Марсе: исследование и доказательства
Жидкая вода все еще может течь на Марсе, но это не значит, что ее легко обнаружить. Поиски воды на Красной планете заняли более 15 лет, чтобы выявить явные признаки того, что жидкость сегодня течет по поверхности. Однако в прошлом реки и океаны могли покрывать землю. Куда делась вся жидкая вода? Зачем? Сколько еще осталось? Наблюдения за Красной планетой показывают, что реки и океаны, возможно, были выдающимися чертами в ее ранней истории. Миллиарды лет назад Марс был теплым и влажным AnTuTu: измерение производительности смартфонов iPhone и Android нельзя сравнивать
Вот так AnTuTu реагирует на запись смартфона Lenovo Z5 Pro , Смартфон Lenovo Z5 Pro был представлен миру как первый смартфон с процессором Snapdragon 855 и 12 ГБ оперативной памяти. Через Развитие дождевой воды
... очистки в первом случае их можно использовать практически только для биологических очистных сооружений. В следующей статье, однако, мы сосредоточимся на втором применении, а именно: отвод дождевой воды на землю. Следует отметить, что если мы сливаем воду, например, со стоянки или производственного цеха, необходимо будет установить коалесцентный сепаратор, который лишит воду веществ, полученных из нефти. Как и все имеющиеся на рынке решения, впитывающие скважины имеют свои преимущества и недостатки. Укладка мужских волос на лице без очистки, это возможно?
Может показаться, что трудно придумать что-то новое в категории бритья или стрижки мужской бороды. Сотни различных видов продуктов для бритья или средств для бороды, доступных на рынке, обычно отличаются только деталями и дизайном. Во всем этом беспорядке и маркетинговом тигле очень трудно найти продукт для себя. Время Чудесная настойка клементина - лекарство от многих проблем со здоровьем
Очищающая настойка. Пчелиная глина (прополис) - акция. Для детей, малыш, во время беременности. Приготовление, рецепт. На водной основе. Дозировка, хранение. Побочные эффекты: аллерген есть. Применение: наружное. Питьевой. Полоскание. Вдыхание. Капли в нос, уши. В сочетании с: Серебряная вода. Физиологическое решение. Мумиё. Эхинацея. Esberitoks. Tsitrosept. Цена. Лапша, сопли. Синусит. Горло, кашель, стенокардия. Flu. Пчелиная глина (прополис) - акция. шпиц
Поморцы просто полны пушистой личности. Скорее всего, вы выбрали ее, потому что вам нравятся помпоны, и вы ожидали, что у нее будут определенные черты, которые будут соответствовать вашему стилю жизни: Очень умный, игривый и энергичный Общительный и дружелюбный Бдительный, любопытный и занятый Защитник семьи - хороший сторож Обучаемый и готов угодить
Комментарии
Малярия, загрязненная вода и высокий уровень преступности?Малярия, загрязненная вода и высокий уровень преступности? Мы опровергаем ложные идеи о путешествии в Азию. В Азии это очень дешево - PRAWDA / FALSE Во многих азиатских странах, таких как Камбоджа, Вьетнам или Индия, вы можете снять комнату или пообедать за гораздо меньшие суммы, чем в Польше. Путешественники в Азию часто могут позволить себе более роскошный уровень жизни и больше удовольствия, чем они могли бы позволить в своей стране происхождения. Однако стоит помнить, Где сегодня вода?
Где сегодня вода? Жидкая вода течет по некоторым крутым, относительно теплым склонам на поверхности Марса. Особенности, известные как повторяющиеся наклонные линии (RSL), были первыми определены в 2011 году в изображениях, сделанных Камера научного эксперимента высокого разрешения (HiRISE) на борту Марс-разведывательного орбитального Могут ли макрофаги препятствовать оттоку воды у кроликов?
Могут ли макрофаги препятствовать оттоку воды у кроликов? Int Ophthalmol. 1984; 7 (2): 87-93. [ PubMed ] [ Google ученый ] 37. Иззотти А., Сакка С.К.,
Куда делась вся жидкая вода?
Зачем?
Сколько еще осталось?
Укладка мужских волос на лице без очистки, это возможно?
Малярия, загрязненная вода и высокий уровень преступности?
Где сегодня вода?
Могут ли макрофаги препятствовать оттоку воды у кроликов?

